Un interessante articolo tratto da European Urology che merita di essere letto
 L’infertilità, così come definita dall’American Society of Reproductive Medicine (ASRM), è l’incapacità di raggiungere una gravidanza con rapporti sessuali regolari non protetti entro 12 mesi. Questa condizione è comune e si verifica nel 10-15% delle coppie in età riproduttiva [1, 2]. Tra le coppie infertili, un fattore maschile che contribuisce è presente in circa la metà di tutti i casi [2]. Le anormalità nei parametri dello sperma (conta spermatica, motilità e / o morfologia) sono spesso osservate in soggetti infertili; tuttavia, i parametri normali dello sperma possono essere visti in alcuni uomini subfertili. L’approccio iniziale a un lavoro di infertilità inizia con una storia meticolosa, seguita da un esame fisico approfondito, studi ormonali e test dello sperma. Il ruolo dell’imaging nella valutazione dell’infertilità maschile è meno enfatizzato, ma può essere cruciale in certe situazioni come gli uomini con ostruzione del dotto eiaculatorio, uno scroto ipoplastico o sospette lesioni ipotalamo-ipofisarie. In generale, l’imaging può essere utilizzato in pazienti opportunamente selezionati per l’intervento diagnostico e terapeutico.
L’infertilità, così come definita dall’American Society of Reproductive Medicine (ASRM), è l’incapacità di raggiungere una gravidanza con rapporti sessuali regolari non protetti entro 12 mesi. Questa condizione è comune e si verifica nel 10-15% delle coppie in età riproduttiva [1, 2]. Tra le coppie infertili, un fattore maschile che contribuisce è presente in circa la metà di tutti i casi [2]. Le anormalità nei parametri dello sperma (conta spermatica, motilità e / o morfologia) sono spesso osservate in soggetti infertili; tuttavia, i parametri normali dello sperma possono essere visti in alcuni uomini subfertili. L’approccio iniziale a un lavoro di infertilità inizia con una storia meticolosa, seguita da un esame fisico approfondito, studi ormonali e test dello sperma. Il ruolo dell’imaging nella valutazione dell’infertilità maschile è meno enfatizzato, ma può essere cruciale in certe situazioni come gli uomini con ostruzione del dotto eiaculatorio, uno scroto ipoplastico o sospette lesioni ipotalamo-ipofisarie. In generale, l’imaging può essere utilizzato in pazienti opportunamente selezionati per l’intervento diagnostico e terapeutico.
La disfunzione sessuale maschile è definita come una difficoltà durante qualsiasi fase dell’incontro sessuale che impedisce o compromette l’attività sessuale dall’individuo o dalla coppia. Ciò include il desiderio sessuale ipoattivo, la disfunzione erettile (DE), la disfunzione eiaculatoria e la disfunzione orgasmica. Clinicamente, la disfunzione sessuale viene diagnosticata attraverso una storia (compresi i questionari) e l’esame obiettivo. L’imaging, come l’ecografia Doppler del pene (US), viene spesso utilizzato per valutare ulteriormente casi complessi o refrattari di ED.
Qui esaminiamo la letteratura corrente sulle modalità di imaging utilizzate per la diagnosi e la gestione della sterilità maschile e della disfunzione sessuale. Una comprensione dei vantaggi e dei limiti di queste modalità di imaging assicurerà che i medici possano ottimizzare la cura del paziente con l’imaging quando necessario.
Applicazione dell’imaging nell’infertilità maschile
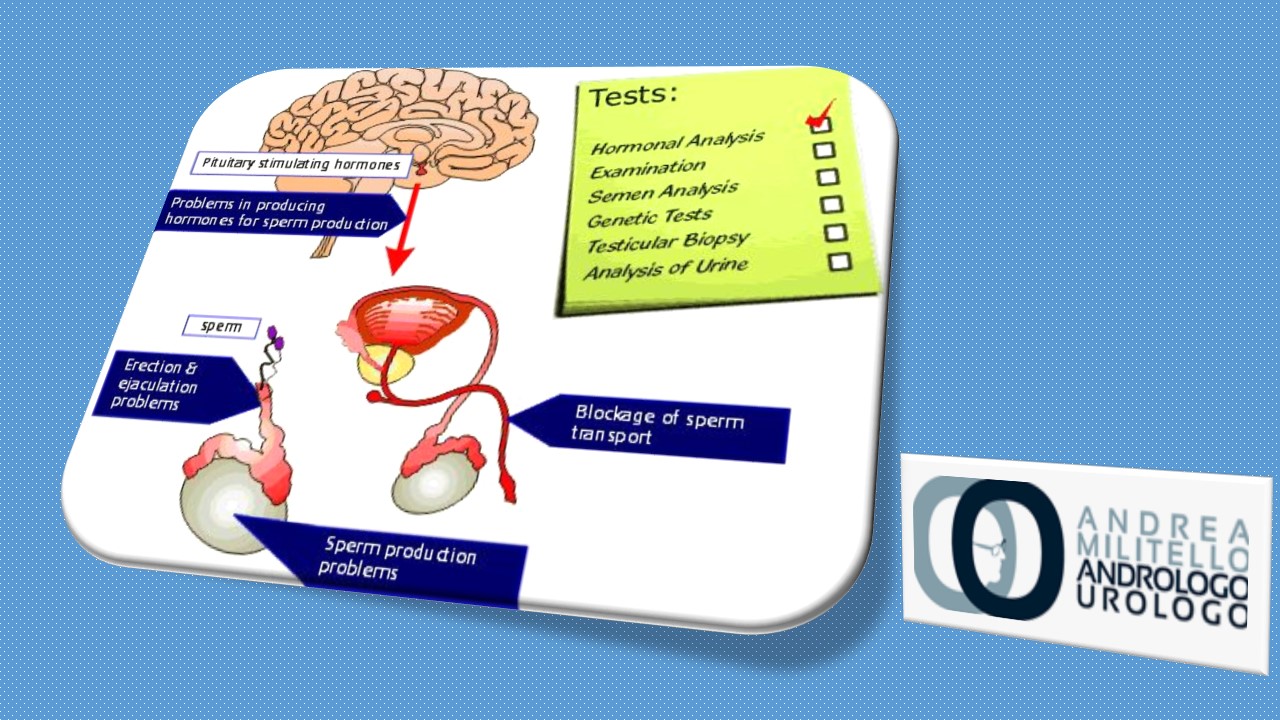
La presenza di spermatozoi nell’eiaculato richiede un asse endocrino intatto per la stimolazione e il supporto della spermatogenesi, nonché un sistema duttale esagerato funzionante per il trasporto degli spermatozoi attraverso il dotto riproduttivo del paziente. La rottura del sistema endocrino endocrino e / o del duttale endovenoso può avere un impatto negativo sui parametri dello sperma, che vanno dall’oligoastocenoterapermia all’azoospermia. Le cause di infertilità maschile possono più specificamente essere classificate come pre-testicolare, testicolare o post-testicolare. Useremo questo paradigma nel discutere il ruolo dell’imaging nella valutazione del maschio infertile.
2.1. Cause pre-testicolare di infertilità maschile
La spermatogenesi si basa sul fine equilibrio dell’asse ipotalamo-ipofisi-gonadico (HPG). L’ormone luteinizzante (LH) e l’ormone follicolo-stimolante (FSH) vengono rilasciati dall’ipofisi anteriore, mentre il testosterone è prodotto dalle cellule di Leydig testicolari. Alterazioni che interessano questi ormoni possono portare a ipogonadismo, che può compromettere la produzione di sperma. L’ipogonadismo ipogonadotropo (HH) è lo stato clinico più comune nelle cause pre-testicolari dell’infertilità maschile. Le eziologie possono essere suddivise in origini congenite, acquisite e funzionali [3]. Le forme più comuni sono l’HH isolato (IHH) e la malattia dell’ipofisi. Cause genetiche / congenite come la IHH e la sindrome di Kallmann (con segni e sintomi associati come anosmia e difetti facciali del viso) sorgono a causa di mutazioni del recettore dell’ormone di rilascio delle gonadotropine (GnRH), riduzione della secrezione di GnRH o migrazione fallita dei neuroni del GnRH dal regione olfattiva all’ipotalamo. Nei pazienti con IHH con livelli di testosterone <150 g / dl con livelli sierici di LH da basso a normale, è indicata la risonanza magnetica cranica (MRI) per valutare le lesioni che occupano spazio come raccomandato dalla American Urological Association (AUA) sul testosterone carenza [4]. La Dichiarazione di consenso europea sull’HH congenita raccomanda inoltre di ottenere l’imaging, poiché alcuni pazienti presenteranno ipoplasia o aplasia alla risonanza magnetica [5].
La malattia dell’ipofisi che provoca un’elevata prolattina circolatoria (iperprolattinemia) che impedisce la secrezione pulsatile del GnRH necessaria per il rilascio di LH e FSH garantisce ulteriori indagini per una lesione strutturale [6]. L’iperprolattinemia è definita come aumento della prolattina nel plasma oltre il limite superiore misurato nella popolazione normale. L’aumento della prolattina può essere responsabile di un calo della libido, della disfunzione erettile e di un minore potenziale di fertilità, e più raramente di ginecomastia e galattorrea [7]. L’iperprolattinemia può derivare da un prolattinoma, microprolattinoma (diametro <10 mm) o macroprolattinoma (diametro> 10 mm). Il livello sierico di prolattina è correlato alla dimensione del prolattinoma e i livelli di prolattina superiori a 80 ng / ml possono essere utilizzati come surrogato per la presenza di un prolattinoma, indipendentemente dalle dimensioni [8]. Inoltre, un set point di 500 ng / ml viene utilizzato per distinguere meglio i prolattinomi da altre eziologie, sebbene altre eziologie raramente determinino livelli di prolattina sierica superiori a 150 ng / ml [9]. Nel contesto della prolattina elevata con preoccupazione per il prolattinoma, la risonanza magnetica focalizzata sulla ghiandola pituitaria è la modalità raccomandata per la visualizzazione ottimale del tumore (Figura 1). Tuttavia, nei casi con microprolattinoma, l’uso di risonanza magnetica può trascurare piccole lesioni a causa della limitazione dello spessore della sezione di 3 mm. Per ovviare a questi inconvenienti e aumentare l’accuratezza diagnostica, sono stati fatti sforzi da parte dei medici per applicare l’imaging dinamico potenziato con gadolinio con acquisizione simultanea di piani coronali e sagittali in casi sospetti. Questo approccio dinamico alla risonanza magnetica è in effetti promettente per la visualizzazione e l’individuazione di una lesione ipofisaria con una frequenza diagnostica che raggiunge il 93%, compresi micro e macroprolattinomi [10]. Le linee guida AUA sul deficit di testosterone raccomandano che gli uomini con testosterone <150 ng / dl e bassi o bassi livelli normali di LH dovrebbero sottoporsi a risonanza magnetica ipofisaria indipendentemente dal livello di prolattina per escludere la possibilità di un’anomalia strutturale come adenomi non decrescenti [4].
2.2. Cause testicolari
L’insufficienza testicolare primaria (cause testicolari di infertilità) si riferisce a disturbi della spermatogenesi intrinseca ai testicoli. Numerose condizioni possono causare disfunzione testicolare e sono considerate come cause testicolari di infertilità maschile, tra cui alcune anomalie cromosomiche / genetiche, effetti avversi dovuti a farmaci, chemioterapia, radioterapia, cancro, infezioni, traumi, criptorchidismo e varicocele. I pazienti con insufficienza testicolare primaria presentano classicamente ipogonadismo ipergonadotropo con o senza atrofia testicolare.
2.2.1. varicocele
Il varicocele si trova in circa il 15% dei maschi, mentre la frequenza sale al 40% tra i maschi con infertilità primaria e fino all’80% tra gli uomini con infertilità secondaria. Ciò suggerisce che in alcuni pazienti il ​​varicocele esercita un declino progressivo della spermatogenesi se non viene trattato [11, 12]. I meccanismi proposti per il deterioramento della spermatogenesi indotto da varicocele includono ipertermia testicolare, ipossia testicolare e reflusso tossico del metabolita dal rene e dalla ghiandola surrenale a causa del flusso retrogrado nella vena spermatica interna [13]. È stato dimostrato che l’ipertermia testicolare è il principale meccanismo patofisiologico, e gli altri meccanismi sono stati ampiamente confutati. Sebbene i varicoceli subclinici (varicoceli osservati solo negli Stati Uniti scrotali e non rilevabili all’esame obiettivo) siano prevalenti tra i maschi in età riproduttiva, solo i varicoceli clinicamente palpabili sono associati con l’infertilità. Dato questo fatto, attualmente non ci sono prove a sostegno dell’uso routinario dell’ecografia per lo screening dei maschi infertili per la valutazione dei varicoceli subclinici. Attualmente non vi sono prove sufficienti a sostegno della correzione chirurgica del varicocele subclinico, dato che studi precedenti hanno dimostrato che la varicocelectomia unilaterale per varicoceli subclinici unilaterali non ha migliorato la qualità dello sperma o l’ulteriore paternità [14]. Uno studio recente ha rilevato che i parametri dello sperma sono migliorati e che i tassi di gravidanza naturali sono aumentati dopo varicocelectomia bilaterale in pazienti di sesso maschile con varicocele sinistro clinico e destro sinistro combinato [15]. Tuttavia, sono necessarie ulteriori prove prima che venga indicato il trattamento del varicocele subclinico.
Mentre lo scrotale negli Stati Uniti non è raccomandato per la valutazione di routine negli uomini infertili, un ecogramma può fornire informazioni utili per la valutazione di casi clinicamente stimolanti per meglio definire risultati di esami fisici indeterminati o ambigui [2]. Quando la diagnosi è inconcludente, color Doppler US è un utile complemento per la rilevazione varicocele, con sensibilità e specificità che raggiungono l’85% (Fig. 2) come un diametro venoso> 2,95 mm durante una manovra di Valsalva può essere rilevata [16]. Un ulteriore sistema di punteggio descritto da Chiou et al [17] che incorpora il diametro massimo venoso, la somma di sei diametri venosi e la variazione della velocità del flusso dopo una manovra di Valsalva consente una maggiore sensibilità del 93% utilizzando un punteggio totale ≥4 rispetto alla mera misurazione il diametro venoso (Tabella 1). Il varicocele intratesticolare, una patologia poco frequente, è rappresentato da reperti ecografici di una vena intratesticolare più ampia di 2 mm. Si presenta tipicamente adiacente al testicolo mediastino e richiede la differenziazione dalla rete testis, che presenta tubuli ramificati dilatati convergenti al mediastino ma senza flusso sanguigno sul Doppler USA [18].
Mentre gli Stati Uniti scrotali non vengono eseguiti di routine in Nord America per la diagnosi di varicocele, un sonogramma è un prerequisito per la definizione del varicocele in Europa. Le linee guida dell’Associazione Europea di Urologia (EAU) sottolineano la necessità del color Doppler USA per la conferma di varicocele clinicamente palpabili. Ciò è in contrasto con le raccomandazioni ASRM, che sconsigliano l’uso abituale negli Stati Uniti nei casi clinicamente confermati [2, 19]. I varicoceli si trovano più comunemente sul lato sinistro, che alcuni ricercatori attribuiscono a (1) l’angolo anatomico acuto del drenaggio venoso gonadico sinistro nella vena renale sinistra, (2) la lunghezza più lunga della vena gonadica sinistra e (3) valvole venose incompetenti. Si ritiene che questi siano responsabili dell’aumento della pressione venosa idrostatica sul lato sinistro [13]. In rari casi, un varicocele o varicocele destro isolato che non si decomprime nella posizione sdraiata dovrebbe richiedere un’indagine per la patologia retroperitoneale. La patologia che include il trombo cavale del tumore renale che ostruisce il drenaggio venoso o le masse retroperitoneali che comprimono in modo estrinseco la vena gonadica sono meglio identificate mediante tomografia computerizzata (TC) dell’addome e della pelvi. È interessante notare che, in un recente studio retrospettivo, un’eziologia maligna è stata riportata nel 2-3% dei pazienti con varicocele destro isolato, ma la lateralità varicocele non era significativamente associata alla diagnosi del tumore intra-addominale entro 1 anno di diagnosi varicocele utilizzando CT come approccio di imaging [20]. Data la variazione dell’anatomia della vena collaterale, la venografia è stata introdotta negli anni ’60 nel tentativo di identificare i canali anastomotici prima del trattamento per ovviare alle recidive [21]. Sono state segnalate sensibilità elevate per la rilevazione del varicocele con la venografia retrograda, ma questa tecnica è anche associata ad un considerevole tasso di falsi positivi [22]. Pertanto, il suo ruolo clinico è riservato ai casi di recidiva di difficoltà per identificare le vene comunicative e in combinazione con l’embolizzazione venosa. Il ruolo diagnostico è quindi molto limitato, in quanto questa tecnica sarebbe in genere considerata solo dopo l’esame obiettivo e, quando incerta, non invasiva negli Stati Uniti.
2.2.2. criptorchidismo
Il criptorchidismo, o testicolo sconsiderato (UDT), è la sede extrascrotale del testicolo, definita come il fallimento di uno o entrambi i testicoli a scendere nello scroto. Se non trattati, gli uomini criptorchidi bilateralmente hanno probabilità di paternità nettamente inferiori rispetto agli uomini con criptorchidismo unilaterale e uomini non criptorchidi [23, 24]. L’intervento chirurgico è tipicamente eseguito tra 6 e 12 mesi di età ed è raccomandato per arrestare la deplezione delle cellule germinali e diminuire il rischio successivo di cancro ai testicoli [25, 26]. Il riconoscimento della corretta posizione testicolare dipende da un attento esame; tuttavia, per gli adolescenti / uomini obesi con un testicolo impalpabile per il quale l’esame obiettivo è inconcludente, può essere offerta una diagnostica per immagini per un testicolo intra-addominale. Secondo le linee guida AUA sul criptorchidismo, l’approccio diagnostico raccomandato per un testicolo impalpabile in un paziente non obeso è laparoscopia diagnostica o esplorazione aperta, mentre gli Stati Uniti possono essere considerati per un paziente obeso. La risonanza magnetica nucleare, la risonanza magnetica e la risonanza magnetica convenzionale sono considerate tecniche di imaging inaffidabili, poiché mancano di sensibilità nella rilevazione di UDT non palpabili, in particolare per l’identificazione di testicoli atrofia e intra-addominali [27]. Le tecniche di risonanza magnetica avanzata come l’imaging pesato alla diffusione (DWI) possono rilevare l’elevata cellularità di un testicolo mostrando un’aumentata densità del segnale oltre a bassa intensità del segnale sulle immagini T1 e un’intensità di segnale elevata sulle immagini T2 MR. Il DWI può integrare le immagini RM convenzionali e localizzare accuratamente gli UDT con una sensibilità che raggiunge il 90%, anche se l’esame invasivo con laparoscopia produce i risultati più affidabili [28]. Al momento il DWI non è raccomandato nella valutazione di routine del criptorchidismo.
2.2.3. Cancro ai testicoli
Secondo un insieme di dati sulle richieste di risarcimento da parte degli assicurati degli Stati Uniti, gli uomini infertili avevano un duplice maggiore rischio di sviluppare un successivo tumore testicolare [29]. In uno studio trasversale, l’incidenza del cancro ai testicoli era 20 volte più probabile tra gli uomini infertili rispetto a una popolazione di controllo, nonostante l’incidenza generale bassa (0,3%) [30]. L’infertilità maschile può insorgere negli uomini con cancro ai testicoli a causa di perturbazioni dell’asse HPG, interruzione della spermatogenesi da parte dell’effetto massa e / o alterazione della barriera sangue / testicolo [31, 32]. Gli Stati Uniti mirati possono migliorare l’individuazione del cancro, ma è importante per i clinici capire che, nel contesto dell’imaging USA per il dolore, solo lo 0,8% dei pazienti presenta lesioni intratesticolari sospette di neoplasie [33]. Mentre il 95% delle masse testicolari palpabili sono maligne, solo il 20% delle masse testicolari non palpabili rilevate negli Stati Uniti testicolari è maligno. A causa degli alti tassi di falsi positivi (rilevamento di masse intratesticolari non palpabili accidentali) per gli Stati Uniti testicolari che sono in definitiva non maligni, gli Stati Uniti testicolari non dovrebbero essere considerati parte di un processo di sterilità di routine. In quelli con una diagnosi indeterminata di una lesione testicolare riscontrata incidentalmente negli Stati Uniti scrotali, la valutazione dell’elasticità dei tessuti tramite sonoelastografia fornisce un’alta sensibilità e specificità nella diagnosi della neoplasia testicolare [34]. Un approccio graduale con l’uso della MRI testicolare ha prodotto sensibilità e specificità> 90% nel differenziare le lesioni maligne da tumori benigni e / o lesioni infiammatorie benigne [35]. La microlitiasi, evidente su un ecogramma come foci ecogeni di 1-2 mm di diametro distribuiti casualmente in uno o due testicoli bilaterali, è presente nell’1,5-5% della popolazione generale e non è associata ad un rischio più elevato di sviluppare il cancro del testicolo in asintomatica individui [36]. Per i tumori intratesticolari non palpabili, l’uso intraoperatorio negli Stati Uniti durante l’escissione può aiutare a localizzare la lesione intratesticolare e facilitare la rimozione della sola lesione, contribuendo così a preservare la fertilità. In questa condizione, gli Stati Uniti intraoperatori sono un aspetto essenziale dell’orchiectomia parziale [37].
2.2.4. Azoospermia non ostruttiva (NOA)
L’assenza di spermatozoi nell’eiaculato (azoospermia) in un apparato riproduttivo non ostruito riflette una grave compromissione della spermatogenesi. Le cause genetiche identificabili più comuni includono la sindrome di Klinefelter (47, XXY) e le microdelezioni cromosomiche Y, ma queste condizioni rappresentano il <30% dei casi di NOA. Miglioramenti nel differenziare l’azoospermia ostruttiva (OA) dal NOA derivano dall’uso di livelli sierici di FSH e lunghezza polare testicolare. L’indagine sull’oro standard per valutare la presenza di spermatozoi è l’estrazione di spermatozoi testicolari con microdissezione [38, 39]. La lunghezza della formula × larghezza × altezza × 0,71 utilizzando le misurazioni statunitensi può essere utilizzata per calcolare il volume testicolare, e una somma di volumi testicoli bilaterali <20 ml, insieme al rilevamento di meno di tre vasi intratesticolari sull’ecografia Doppler sono stati suggeriti per identificare 70 % di pazienti con NOA [40, 41]. Nonostante queste intuizioni, gli Stati Uniti testicolari non sono abitualmente indicati nel workup di un paziente che presenta NOA.
2.3. Cause post-testicolare
L’infertilità maschile può essere dovuta a un’ostruzione che impedisce allo sperma di essere trasportato fuori dal tratto riproduttivo maschile al momento dell’eiaculazione. Le cause più comuni sono l’assenza unilaterale o bilaterale congenita del dotto deferente (CBAVD), l’ostruzione epididimale e l’ostruzione del dotto eiaculatorio. Il CBAVD è di natura genetica ed è legato a mutazioni nel gene CFTR o malformazione renale. Altre cause di ostruzione possono essere infezioni, traumi o interventi chirurgici come la vasectomia.
Nei casi di azoospermia ostruttiva, la spermatogenesi è tipicamente normale, quindi il recupero di spermatozoi chirurgici da utilizzare nella fecondazione in vitro è possibile tramite l’iniezione intracitoplasmatica di spermatozoi. Negli uomini la cui ostruzione è secondaria a una precedente vasectomia o ostruzione epididimale, la ricostruzione chirurgica può essere tipicamente intrapresa per ristabilire la pervietà e facilitare gli sforzi per concepire con mezzi naturali.
2.3.1. CBAVD
Embryologicamente, la vescicola seminale, epididimo e dotto deferente hanno la stessa origine, vale a dire il dotto mesonefrico (dotto Wolffiano). Pertanto, l’assenza congenita del dotto deferente è solitamente associata all’assenza di vescicole seminali e del canale eiaculatorio. Mutazioni del gene CFTR possono causare anomalie congenite del dotto deferente, in particolare nei pazienti con CBAVD senza agenesia renale [42]. La distruzione della sintesi, del traffico e della funzione della proteina CFTR è suddivisa in sei classi funzionali. Le classi I, II e III sono considerate mutazioni gravi che si traducono in fenotipi gravi, mentre le classi di difetti molecolari IV, V e VI sono associate a fenotipi lievi, in quanto viene conservata una certa funzione residua della proteina CFTR [43]. L’assenza unilaterale congenita dei vasi deferenti (CUAVD) e CBAVD è indicata come forme monosintomatiche di fibrosi cistica (CF), in cui la principale composizione genetica è costituita da due alleli mutanti lievi o una combinazione di un allele mutante severo e lieve (eterozigoti composti ), invece dei due gravi alleli mutanti comunemente osservati nei pazienti CF classici. Fino al 25% dei casi di azoospermia ostruttiva nei caucasici sono correlati al CBAVD e l’alta frequenza rilevata può essere spiegata dall’elevata velocità portante di 1 su 25 nei caucasici e da gravi mutazioni come F508del presenti in 1 su 30 caucasici [42 ]. Un altro sottogruppo di pazienti con CBAVD sono maschi senza anomalie del gene CFTR identificabili e concomitante agenesia renale unilaterale [44]. Le analisi dello sperma per i pazienti con CBAVD mostrano tipicamente azoospermia e segni di ostruzione (sperma acido, contenuto di fruttosio assente e basso volume dell’eiaculato); l’esame obiettivo può rivelare un impalpabile dotto deferente. Nei maschi con obesità o uno scroto a cavallo alto, che impediscono una diagnosi conclusiva della presenza o assenza di dotto deferente, gli Stati Uniti scrotali possono facilitare il rilevamento di una struttura simile a cordone con due riflessioni lineari parallele che rappresentano le pareti interne e muscolari dei dotti deferenti [ 45]. La RM e gli US transrettali (TRUS) possono anche essere considerati per la valutazione delle vescicole seminali. Il CBAVD è solitamente associato all’aplasia delle vescicole seminali, a differenza dell’ostruzione del dotto eiaculatorio, per cui le vescicole seminali dilatate possono essere tipicamente osservate su TRUS o RM. Pertanto, nei casi di basso volume dell’eiaculato (<1 ml) in azoospermia ostruttiva con dotto deferente assente o nei casi di azoospermia ostruttiva volume normale (ostruzione epididimale), non è indicata alcuna immagine. Tuttavia, l’imaging TRUS è indicato nei casi di azoospermia ostruttiva a basso volume con dotto deferente palpabile, che suggerisce una possibile ostruzione del dotto eiaculatorio.
L’ecografia renale dovrebbe essere offerta ai pazienti con CBAVD, poiché una proporzione di questi pazienti senza anomalie identificabili del gene CFTR può avere agenesia renale unilaterale [46].
2.3.2. Ostruzione del condotto eiaculatorio (EDO)
L’EDO deve essere sospettata in un paziente con dotto deferente bilaterale palpabile e volume basso dell’eiaculato (<1 ml), sperma di pH acido e azoospermia. TRUS viene utilizzato per facilitare la diagnosi, con dilatazione dell’asse trasversale della vescicola seminale (diametro della sezione interna> 1,5 cm), dilatazione delle ampolle vasali (> 6 mm) o presenza di una cisti prostatica di linea mediana (cisti mulleriane) / cisti paramedie prostatiche (Wolffiane) (Fig. 3) [47] che indicano l’eventuale ostruzione. L’aspirazione seminale delle vescicole tramite un approccio TRUS viene eseguita come passo successivo; se lo sperma viene trovato, l’ostruzione del dotto eiaculatorio è confermata. La vesiculografia seminale guidata da TRUS viene eseguita utilizzando un ago con punta ecogena per perforare la vescicola seminale e successiva iniezione di contrasto non ionico per l’imaging radiografico. Questa tecnica è un altro studio aggiuntivo usato clinicamente per aiutare a visualizzare il tratto riproduttivo distale per ottenere informazioni anatomiche sul sito di blocco [48]. Inoltre, insieme a TRUS, concomitante cromatubazione del dotto eiaculatorio tramite iniezione di blu di metilene in modo anterogrado dalla vescicola seminale può facilitare la visualizzazione cistoscopica diretta dell’efflusso di blu di metilene dall’orifizio del dotto eiaculatorio, fornendo ulteriori prove riguardo l’EDO completa o parziale in uomini azoospermici o oligospermici con basso volume dell’eiaculato che potrebbero beneficiare di un’ulteriore resezione transuretrale del dotto eiaculatorio [49].
Oltre alle cisti della linea mediana e alle cisti dei dotti eiaculatori, altre lesioni cistiche come le cisti delle vescicole seminali e il siringocele della ghiandola di Cowper possono essere identificate casualmente dagli Stati Uniti, ma in genere non causano infertilità. Mentre la vasografia può aiutare a confermare la presenza di ostruzione del dotto deferente e del dotto eiaculatorio, considerando il rischio associato di stenosi iatrogenica di dotto deferente, questa metodologia diagnostica invasiva non è raccomandata se non viene eseguita intraoperatoriamente durante le procedure ricostruttive.
2.3.3. Infezione
L’infezione del tratto riproduttivo dovuta a patogeni sessualmente trasmessi o batteri enterici tramite diffusione retrograda può causare infiammazione dell’epididimo e dei testicoli. Questi cambiamenti possono a loro volta causare la fibrosi di queste strutture, con conseguente ostruzione del trasporto di spermatozoi attraverso il sistema duttale in atto. Gli Stati Uniti si sono esibiti durante lo stadio acuto dell’infiammazione, di solito mostra un aumento del flusso sanguigno a causa di iperemia [18]. Gli ascessi sono una scoperta molto meno comune in questa impostazione.
3. Applicazione dell’imaging nella disfunzione sessuale
Disfunzioni sessuali e disturbi del desiderio possono colpire chiunque e manifestarsi a qualsiasi età. La promessa perduta di adempiere alla vita sessuale può quindi gravare pesantemente su una coppia. Indipendentemente dal problema, è spesso difficile discernere ciò che è fisiologico o psicologico. Mentre l’obiettivo principale del trattamento della disfunzione sessuale è di raggiungere rapporti soddisfacenti e di successo in alcuni e la ricomparsa dell’eiaculazione o del raggiungimento dell’orgasmo in altri, l’analisi dell’organo sporgente superficiale (il pene) per escludere un’anomalia organica rende questo un approccio ragionevole in tali casi.
3.1. Disfunzione erettile
L’introduzione degli inibitori della fosfodiesterasi 5 alla fine degli anni ’90 ha rivoluzionato il trattamento del DE e medici e pazienti hanno sperimentato uno spostamento verso questo approccio per il trattamento di prima linea. L’uso del duplex Doppler negli Stati Uniti è diminuito e il suo ruolo è stato riservato al disordine erettile primario, ED secondaria correlata al trauma pelvico, deformità peniena congenita o acquisita, ragioni legali, prima di protesi peniena e / o fallimento di trattamenti orali, come raccomandato dal EAU [50]. Tuttavia, negli ultimi anni è stato dimostrato che l’ED è collegata alla disfunzione endoteliale e può servire da proxy per la malattia coronarica occulta. L’incidenza di DE è di 3-5 anni prima dei sintomi coronarici [51]. Per essere più specifici, l’ED vasculogenica è il precursore delle malattie cardiovascolari ed è obbligatorio differenziare la causa psicogena e altre cause di DE prima di iniziare la valutazione cardiaca. L’esame Doppler negli Stati Uniti per la vascolarizzazione del pene può essere utilizzato come surrogato per la valutazione della disfunzione endoteliale e determinare la necessità di un’ulteriore stratificazione del rischio cardiaco; particolarità in soggetti giovani di età <50 anni senza evidenti fattori di rischio cardiovascolare. L’identificazione tramite Doppler USA può comportare un intervento precoce e prevenire un ritardo nella diagnosi degli eventi cardiovascolari aterosclerotici in corso [52, 53]. Misurazione quantitativa della velocità del flusso picco-sistolico dell’arteria cavernosa (PSV) e della velocità del flusso diastolico finale (EDV) del fallo dopo l’iniezione peniena di un agente vasoattivo (alprostadil o una combinazione di alprostadil / fentolamina / papaverina) utilizzando una frequenza elevata sonda lineare per la scansione del lato ventrale del pene con viste trasversali e longitudinali per il calcolo dell’indice resistivo vascolare (RI) consente ai medici di stratificare l’eziologia ED. I parametri Doppler considerati normali dopo stimolazione farmacologica sono PSV> 35 cm / s, EDV <5 cm / s, e RI> 0,9 (Fig. 4). Il PSV <25 cm / s è associato a insufficienza arteriosa, mentre la normale pressione sistolica (> 25 cm / s) associata a EDV> 5 cm / s o RI <0,75 è definita come ED venogenica (Fig. 5), ma occasionalmente richiede ripetizione test per confermare la diagnosi (Fig. 4, Fig. 5) [54, 55].
L’uso della tecnica minimamente invasiva chiamata infusione dinamica cavernosometria e cavernosografia (DICC) per valutare la funzione veno-occlusiva arteriosa e corporale può essere selezionato per un numero limitato di pazienti, ma è stato eseguito meno frequentemente dal 1990 a causa del suo livello di invasività e tempo di procedura lungo. Sebbene mancano criteri standard per definire l’impotenza arteriogenica o venogenica, la DICC è considerata l’approccio più completo per la diagnosi della disfunzione veno-occlusiva e l’identificazione di vasi venosi anomali di drenaggio prima della chirurgia di correzione vascolare generalmente utilizzata per pazienti giovani ED [56].
3.2. La malattia di Peyronie
La curvatura del pene, dovuta principalmente alla malattia di Peyronie, è responsabile del dolore del pene e della difficoltà con il rapporto penetrativo ed è una fonte di sofferenza psicologica. Le curvature acquisite del pene sono essenzialmente di origine post-traumatica. La condizione è caratterizzata dalla formazione di placca fibrosa alla tunica albuginea del pene che può successivamente calcificare e causare perdita di elasticità e curvatura [57]. La storia naturale della malattia e il suo esito clinico variano dalla risoluzione spontanea alla deformazione progressiva del pene con disagio durante il sesso. Duplex Doppler US in questa impostazione può servire come modalità utile per documentare la posizione della placca calcificata, così come la pervietà delle arterie cavernose e la presenza di perdite venose. Inoltre, la risonanza magnetica ha una migliore risoluzione del contrasto e può facilitare il rilevamento della p
